您现在的位置是: 首页 > 汽车测评 汽车测评
bac质粒提取_BAC质粒提取试剂盒
佚名 2024-05-30 人已围观
简介bac质粒提取_BAC质粒提取试剂盒_BAC质粒提取试剂盒谢谢大家对bac质粒提取问题集合的提问。作为一个对此领域感兴趣的人,我期待着和大家分享我的见解和解答各个问题,希望能对大家有所帮助。1.质粒的分离操作2.质粒的提取以
谢谢大家对bac质粒提取问题集合的提问。作为一个对此领域感兴趣的人,我期待着和大家分享我的见解和解答各个问题,希望能对大家有所帮助。
1.质粒的分离操作
2.质粒的提取以及放回
3.农杆菌质粒DNA常用的提取方法?
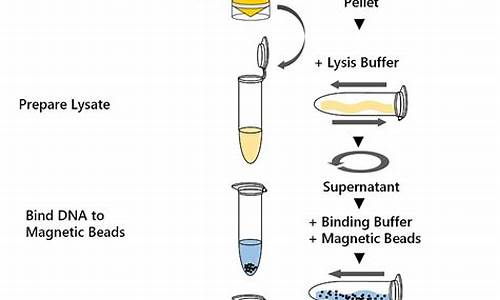
质粒的分离操作
从细菌中分离质粒 DNA 的具体操作 一、材料含PBS的E.coliDH5α或JM系列菌株,1.5ml塑料离心管(又称eppendorf管),离心管架。
二、设备
微量取液器(20μl,200μl,1000μl),台式高速离心机,恒温振荡摇床,高压蒸汽消毒器(灭菌锅),涡旋振荡器,电泳仪,琼脂糖平板电泳装置和恒温水浴锅等。
三、试剂
1、LB液体培养基(Luria-Bertani):称取蛋白胨(Tryptone)10g,酵母提取物(Yeastextract)5g,NaCl10g,溶于800ml去离子水中,用NaOH调pH至7.5,加去离子水至总体积1升,高压下蒸气灭菌20分钟。
2、LB固体培养基:液体培养基中每升加12g琼脂粉,高压灭菌。
3、氨苄青霉素(Ampicillin,Amp)母液:配成50mg/ml水溶液,-20℃保存备用。
4、溶菌酶溶液:用10mmol/LTris·Cl(pH8.0)溶液配制成10mg/ml,并分装成小份(如1.5ml)保存于-20℃,每一小份一经使用后便予丢弃。
5、3mol/lNaAc(pH5.2):50ml水中溶解40.81gNaAc·3H2O,用冰醋酸调pH至5.2,加水定容至100ml,分装后高压灭菌,储存于4℃冰箱。
6、溶液1:50mmol/L葡萄糖,25mmol/ L T r i s. Cl(pH8.0),10mmol/LEDTA(pH8.0)。溶液Ⅰ可成批配制,每瓶100ml,高压灭菌15分钟,储存于4℃冰箱。
7、溶液Ⅱ:0.2mol/LNaOH(临用前用10mol/LNaOH母液稀释),1%SDS。
8、溶液Ⅲ:5mol/LKAc60ml,冰醋酸11.5ml,H2O28.5ml,定容至100ml,并高压灭菌。溶液终浓度为:K+3mol/L,Acˉ5mol/L。
9、RNA酶A母液:将RNA酶A溶于10mmol/LTris·Cl(pH7.5),15mmol/LNaCl中,配成10mg/ml
的溶液,于100℃加热15分钟,使混有的DNA酶失活。冷却后用1.5mleppendorf管分装成小份保存于-20℃。
10、饱和酚:市售酚中含有醌等氧化物,这些产物可引起磷酸二酯键的断裂及导致RNA和DNA的交联,应在160℃用冷凝管进行重蒸。重蒸酚加入0.1%的8-羟基喹啉(作为抗氧化剂),并用等体积的0.5mol/LTris·Cl(pH8.0)和0.1mol/LTris·Cl(pH8.0)缓冲液反复抽提使之饱和并使其pH值达到7.6以上,因为酸性条件下DNA会分配于有机相。
11、氯仿:按氯仿:异戊醇=24:1体积比加入异戊醇。氯仿可使蛋白变性并有助于液相与有机相的分开,异戊醇则可起消除抽提过程中出现的泡沫。按体积/体积=1:1混合上述饱和酚与氯仿即
得酚/氯仿(1:1)。酚和氯仿均有很强的腐蚀性,操作时应戴手套。
12、TE缓冲液:10mmo/LTris·Cl(pH8.0),1mmol/LEDTA(pH8.0)。高压灭菌后储存于4℃冰箱中。
13、STET:0.1mol/LNaCl,10mmol/LTris·Cl(pH8.0),10mmol/LEDTA(pH8.0),5%TritonX-100。
14、STE:0.1mol/LNaCl,10mmol/LTris·Cl(pH8.0),1mmol/LEDTA(pH8.0)。
15、电泳所用试剂:⑴TBE缓冲液(5×):称取Tris54g,硼酸27.5g,并加入0.5MEDTA(pH8.0)20ml,定溶至1000ml。⑵上样缓冲液(6×):0.25%溴酚蓝,40%(w/v)蔗糖水溶液。 一、细菌的培养和收集
将含有质粒pBS的DH5α菌种接种在LB固体培养基(含50μg/mlAmp)中,37℃培养12-24小时。用无菌牙签挑取单菌落接种到5mlLB液体培养基(含50μg/mlAmp)中,37℃振荡培养约12小时至对数生长后期。
二、质粒DNA少量快速提取
质粒DNA小量提取法对于从大量转化子中制备少量部分纯化的质粒DNA十分有用。这些方法共同特点是简便、快速,能同时处理大量试样,所得DNA有一定纯度,可满足限制酶切割、电泳分析的需要。
(一)、煮沸法
1、将1.5ml培养液倒入eppendorf管中,4℃下12000转离心30秒。
2、弃上清,将管倒置于卫生纸上几分钟,使液体流尽。
3、将菌体沉淀悬浮于120mlSTET溶液中,涡旋混匀。
4、加入10ml新配制的溶菌酶溶液(10mg/ml),涡旋振荡3秒钟。
5、将eppendorf管放入沸水浴中,50秒后立即取出。
6、用微量离心机4℃下12000g离心10分钟。
7、用无菌牙签从eppendorf管中去除细菌碎片。
8、取20ml进行电泳检查。
[注意]1.对大肠杆菌可从固体培养基上挑取单个菌落直接进行煮沸法提取质粒DNA。2.煮沸法中添加溶菌酶有一定限度,浓度高时,细菌裂解效果反而不好。有时不同溶菌酶也能溶菌。3.提取的质粒DNA中会含有RNA,但RNA并不干扰进一步实验,如限制性内切酶消化,亚克隆及连接反应等。
(二)、碱法
1、取1.5ml培养液倒入1.5mleppendorf管中,4℃下12000g离心30秒。
2、弃上清,将管倒置于卫生纸上数分钟,使液体流尽。
3、菌体沉淀重悬浮于100μl溶液Ⅰ中(需剧烈振荡),室温下放置5-10分钟。
4、加入新配制的溶液Ⅱ200μl,盖紧管口,快速温和颠倒eppendorf管数次,以混匀内容物(千万不要振荡),冰浴5分钟。
5、加入150μl预冷的溶液Ⅲ,盖紧管口,并倒置离心管,温和振荡10秒,使沉淀混匀,冰浴中5-10分钟,4℃下12000g离心5-10分钟。
6、上清液移入干净eppendorf管中,加入等体积的酚/氯仿(1:1),振荡混匀,4℃下12000g离心5分钟。
7、将水相移入干净eppendorf管中,加入2倍体积的无水乙醇,振荡混匀后置于-20℃冰箱中20分钟,然后4℃下12000g离心10分钟。
8、弃上清,将管口敞开倒置于卫生纸上使所有液体流出,加入1ml70%乙醇洗沉淀一次,4℃下12000g离心5-10分钟。
9、吸除上清液,将管倒置于卫生纸上使液体流尽,真空干燥10分钟或室温干燥。
10、将沉淀溶于20μlTE缓冲液(pH8.0,含20μg/mlRNaseA)中,储于-20℃冰箱中。
[注意]1.提取过程应尽量保持低温。2.提取质粒DNA过程中除去蛋白很重要,采用酚/氯仿去除蛋白效果较单独用酚或氯仿好,要将蛋白尽量除干净需多次抽提。3.沉淀DNA通常使用冰乙醇,在低温条件下放置时间稍长可使DNA沉淀完全。沉淀DNA也可用异丙醇(一般使用等体积),且沉淀完全,速度快,但常把盐沉淀下来,所以多数还是用乙醇。
(三)、Wizard少量DNA纯化系统
Promega公司的Wizard少量DNA纯化系统可快速有效的抽提质粒DNA,整个过程只需15分钟。提取的质粒可直接用于DNA测序、酶切分析和体外转录等。该系统中所含试剂和柱子可以用于50次1-3ml质粒培养液的分离和纯化,试剂包括10ml细胞悬浮液,10ml细胞裂解液;10ml中和液,50mlWizard少量DNA纯化树脂,50ml柱洗液(使用前加95%乙醇至120ml)和50支Wizard微型柱。
1、1-3ml过夜培养细胞液4℃下12000g离心1-2分钟。
2、去除上清液,菌体细胞悬浮于200μl细胞悬浮液中,充分混合,并移入eppendorf管中。
3、加200μl细胞裂解液,颠倒离心管数次,直到溶液变清亮。
4、加200μl中和液,颠倒离心管数次。
5、4℃下12000g离心5分钟,取上清液于新的eppendorf管中。
6、加1mlWizard少量DNA纯化树脂,颠倒离心管数次以充分混匀。
7、取一次性注射器,取出注塞,并使注射筒与Wizard微型柱连接,用移液枪将上述混合液加入注射筒中,并用注塞轻推,使混合物进入微型柱。
8、将注射器与微型柱分开,取出注塞,再将注射筒与微型柱相连,加入2ml柱洗液,并用注塞轻推,使柱洗液进入微型柱。
9、取出微型柱置于eppendorf管中,离心2分钟以除去微型柱中的柱洗液。
10、将微型柱放在一个新eppendorf管中,加50μlTE(或水)于微型柱中,静止1分钟后,4℃下12000g离心20秒。
11、丢弃微型柱,将eppendorf管中的质粒DNA贮于4℃或-20℃冰箱。
[注意]树脂使用前应充分混匀,如有结晶,可将树脂用25-37℃水浴处理10分钟。
三、质粒DNA的大量提取和纯化
在制作酶谱、测定序列、制备探针等实验中需要高纯度、高浓度的质粒DNA,为此需要大量提取质粒DNA。大量提取的质粒DNA一般需进一步纯化,常用柱层析法和氯化绝梯度离心法。
(一)、碱法
1、取培养至对数生长后期的含pBS质粒的细菌培养液250ml,4℃下5000g离心15分钟,弃上清,将离心管倒置使上清液全部流尽。
2、将细菌沉淀重新悬浮于50ml用冰预冷的STE中(此步可省略)。
3、同步骤1方法离心以收集细菌细胞。
4、将细菌沉淀物重新悬浮于5ml溶液I中,充分悬浮菌体细胞。
5、加入12ml新配制的溶液Ⅱ,盖紧瓶盖,缓缓地颠倒离心管数次,以充分混匀内容物,冰浴10分钟。6、加9ml用冰预冷的溶液Ⅲ,摇动离心管数次以混匀内容物,冰上放置15分钟,此时应形成白色絮状沉淀。
7、4℃下5000g离心15分钟。
8、取上清液,加入50mlRNA酶A(10mg/ml),37℃水浴20分钟。
9、加入等体积的饱和酚/氯仿,振荡混匀,4℃下12000g离心10分钟。
10、取上层水相,加入等体积氯仿,振荡混匀,4℃下12000g离心10分钟。
11、取上层水相,加入1/5体积的4mol/LNaCl和10%PEG(分子量6000),冰上放置60分钟。
12、4℃下12000g离心15分钟,沉淀用数ml70%冰冷乙醇洗涤,4℃下12000g离心5分钟。
13、真空抽干沉淀,溶于500mlTE或水中。
[注意]1.提取过程中应尽量保持低温。2.加入溶液Ⅱ和溶液Ⅲ后操作应混和,切忌剧烈振荡。3.由于RNA酶A中常存在有DNA酶,利用RNA酶耐热的特性,使用时应先对该酶液进行热处理(80℃1小时),使DNA酶失活。
(二)、Wazard大量DNA纯化系统
碱法大量提取DNA往往需要很长的时间.Promega公司的Wiazrd大量DNA纯化系统既简单又快速,只需要离心和真空抽干,这个系统可以从500ml培养液中在3小时以内获得1mg以上的高质量的质粒DNA(200-20000bp)。该系统不需要酚和氯仿抽提,纯化后的DNA溶于水或TE缓冲液中,不含任何盐份,可以直接用于DNA序列分析和酶切反应,也可以用于在核酸酶抑制剂(如RNasin)存在的条件下进行体外转录反应等。该系统中含有的试剂和柱子可以用于10次100-500ml质粒培养液的分离和纯化,试剂包括:150ml细胞悬浮液,150ml细胞裂解液,150ml中和液,100mlWizard大量DNA纯化树脂,125mlWizard柱子洗脱溶液和10支Wizard带有存储离心管的柱子。
1、100-500ml细胞培养液置离心管中,22-25℃下5000g离心10分钟,所得细胞沉淀充分悬浮于细胞悬浮液中。
2、加15ml细胞裂解溶液并轻轻混合,可以反复倒置混合,但不能用涡旋振荡,细胞裂解完全时,溶液会变清,这一步需要20分钟。
3、加15ml中和溶液,立即反复倒置离心管数次,并使之混匀。
4、14000g,22-25℃离心15分钟。
5、小心地将上清液吸出并移至一个新离心管中。
6、加0.5倍体积的异丙醇,混合均匀,14000g22-25℃下离心15分钟。
7、弃上清,悬浮DNA沉淀于2mlTE缓冲液中。这一步中也许有的沉淀不能溶解。
8、加10mlWizard大量DNA纯化树脂溶液,并涡旋混合。
9、每一个样品,使用一支Wizard大量柱子,柱子的头插在真空器上(Promega产品,与此配套)。
10、将树脂/DNA混合液转入柱子中,真空抽取树脂/DNA混合液。
11、将树脂/DNA混合液抽干后,加13ml柱子洗脱溶液至离心管中,对管底部的树脂/DNA进行洗脱(柱子一边旋转一边加入洗脱液),并加入柱子中。
12、真空抽干所加入的洗脱。
13、再加12ml柱子洗脱液进柱子并抽干。
14、加入5ml80%乙醇漂洗柱中的树脂,柱子真空抽干后将柱子放入用户提供的离心管
中,2500rpm(1300g)离心5分钟。
15、取出柱子,真空抽干5分钟,再将柱子放入系统中所提供的离心管中,2500rpm(1300g)离心5分钟。
16、在柱子中加入1.5ml65-70℃预热过的灭菌重蒸水或TE,1分钟后2500rpm(1300g)离心柱子/离心管5分钟。
17、取出柱子,离心管中溶液即为提取的质粒DNA,可以直接放在离心管中,盖上盖子,储存在4℃或-20℃备用。
[注意]1.在使用之前,系统所提供的柱子洗脱液按1:1加入125ml95%乙醇。2.纯化树脂必须混匀后再用.
(三)、Sephrose2B柱纯化质粒DNA
碱法提取的质粒DNA即使用RNA酶处理,仍会含有少量RNA。当有些试验需无RNA污染的DNA制品时,则需进行进一步纯化。一般常用Sepharose2B或Sepharose4B进行纯化,该方法具有快速,条件温和,重复性好,载体物质可以再利用等优点,因而已广泛用于质粒DNA纯化。
1、将Sepharose2B经含0.1%SDS的TE(pH8.0)平衡后上柱。
2、将至多1ml的DNA溶液铺在Sepharase2B柱上。
3、待DNA溶液完全进入柱内后立即在柱的上部连接含有0.1%SDS的TE(pH8.0)贮液瓶。
4、以1ml流出液为1份进行收集。
5、对每一管测定其OD260值,以确定哪些管中含有质粒DNA。通常质粒DNA在柱上流出的第一个峰中。
6、合并所有含质粒的洗脱液,用等体积的酚/氯仿(1:1)抽提,4℃下12000g离心2分钟,将上层水相转入新管。
7、加入2倍体积的冰冷无水乙醇,-20℃下沉淀10分钟,然后4℃下12000g离心10分钟,弃去上清液。
8、沉淀加70%乙醇洗涤,4℃下12000g离心10分钟,弃去上清液。
9、沉淀真空抽干,重新溶于TE或无菌水中。
[注意]在装柱过程中,要防止柱床中出现断裂或气泡现象,要使界面保持平整。对新装成的柱,应用含0.1%SDS的TE平衡,以使柱内的凝胶均匀。
质粒的提取以及放回
细菌人工染色体(Bacterial artificial chromosome,BAC)是指一种以F质粒(F-plasmid)为基础建构而成的细菌染色体克隆载体,长用来克隆150kb左右大小的DNA片段,最多可保存300kb个碱基对。 该质粒主要包括oriS,repE(控制F质粒复制)和parA、parB(控制拷贝数)等成分。以BAC为基础克隆的载体成嵌合体的频率较低,转化效率高,而且以环状结构存在于细菌体内,易于分辨和分离纯化,已被科学界广泛接受。
农杆菌质粒DNA常用的提取方法?
提取的话有专用的试剂盒(就是可以购买的快速完成特定实验的东西),也有很详细的步骤,主要是配好几个溶液挨个来就行了,基本上就是破膜,然后清除掉其他东西最后把DNA溶解在TE溶液里
接下来使用酶切试剂酶切,比如哦们实验室用的一种环状质粒,就是从中间特定位点断开(用酶切开),然后按照比例将目的基因、连接试剂等混合,让目的基因连接到断开的两个位点上。
之后就是转染,一般用脂质体来实现。就是用脂质体(类似于细胞膜)包括起来连接好的质粒,然后就可以被细胞吸收。
大概就是 提质粒-酶切-连接-转染
具体细节太复杂了,而且不同的体系还要更换不同的试剂和反应条件,可能需要查下文献。
一、从在含20 mg/l Kanamycin和15 mg/l Gentamycin 5-8 ml的液体LB培养基中接种Agrobacterium细胞,然后在28℃、200-220 rpm培养24 h。然后进行质粒提取。 二、新鲜配制Sol II溶液(880 l H2O, 100 l SDS 10%, 20 l 10 N NaOH),及包含 4 mg/ml溶菌酶Lysozyme 的200 l Sol I (P1)溶液。 三、对培养一昼夜的的Falcon试管在3600 rpm速度下进行离心12 min,丢弃上清。 四、用200 l 5 M NaCl重悬农杆菌细胞,利用涡旋将农杆菌细胞混匀。转移到Eppendorf管中。 生物帮有相关问题的详细介绍,分子生物学洗涤剂 /101184/
好了,今天关于“bac质粒提取”的话题就到这里了。希望大家通过我的介绍对“bac质粒提取”有更全面、深入的认识,并且能够在今后的学习中更好地运用所学知识。
上一篇:AC Cars Ltd.









